新概念生物工程细胞器:二维相分离与遗传密码
通过酶进化或者蛋白质人工设计将新功能转入真核生物细胞系统之中是一项重要且艰巨的挑战。细胞并不完全依赖基于DNA的进化来产生新的功能,也会通过形成膜包被或无膜的细胞器来分隔并执行复杂的不同分子过程。生命系统如何发展出更加复杂的过程并获得新的功能,不仅仅是进化生物学的中心问题,也是合成生物学家努力在宿主中创造新的复杂功能时必须考虑的重要问题。因此,为了开发细胞中的新功能,有必要使得不同生物分子之间各自独立,不产生交叉反应。
2021年8月24,德国Johannes Gutenberg University Mainz的Edward A. Lemke研究组发文题为Dual film-like organelles enable spatial separation of orthogonal eukaryotic translation,应用这一原理和二维相分离的概念,作者们开发了一种膜类似生物合成细胞器,支持各种细胞膜表面的蛋白质翻译。

合成生物学中创造细胞新功能的其中一个重要工具是遗传密码子扩展技术(Genetic code expansion,GCE),可以将体内的非经典氨基酸(noncanonical amino acids,ncAAs)位点特异性结合到蛋白质中【1,2】。中心法则中蛋白的翻译依赖于氨酰-tRNA合成酶aaRS/tRNA配对。为了改变aaRS/tRNA配对的用途,以编码特定宿主的非经典氨基酸,通常会使用来自进化上高度不同的生物体、与目标宿主中正交的的aaRS/tRNA配对。在哺乳动物细胞的遗传密码子扩展技术中,最常用的PylRS/tRNAPyl配对,该配对来源于产甲烷古菌(Methanogenic archaea)【3】。通常tRNAPyl被用来解码相对罕见的终止密码子,如琥珀终止密码子TAG它负责终止人类20%的蛋白质翻译,该终止密码子被选择性地插入到感兴趣蛋白的编码序列中,而正常的全长蛋白只有在非经典氨基酸PylRS/tRNAPyl配对结合到在所选位点时才能形成,因此该技术也称为琥珀抑制(Amber suppression)。
在真核生物中应用遗传密码子扩展技术的技术难点主要有三,1)翻译过程mRNA缺乏特异性,可能会出现误翻译;2)在不改变宿主功能的情况下,能够被重新分配的密码子数量有限;3)缺乏正交aaRS/tRNA配对。为了解决这一问题,作者们开发了正交翻译(Orthogonally translating,OT)细胞器系统,在相分离基础上靶向微管末尾形成的微米尺寸大小的细胞器【4】。相分离发生在某些蛋白的临界浓度以上,这些可以发生相分离的蛋白融合到PylRS和ms2噬菌体外壳蛋白MCP之上,目标蛋白mRNA在3'非翻译区域由于连接了重复的ms2茎环结构可以被MCP结合所标记,从而可以将mRNA募集到特定的细胞器中【4】(图1)。
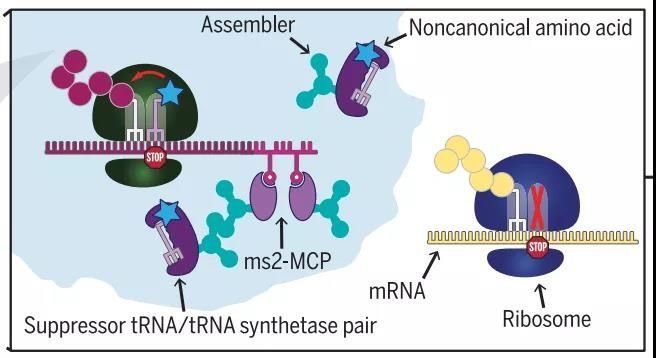
图1 正交翻译OT细胞器工作原理模式图
基于此研究,作者们对该正交翻译细胞器系统进行了优化升级,利用不同的膜表面的二维蛋白质相分离来建立膜类似的生物化学微环境,从而可以在不同的亚细胞分辨率上调整蛋白质翻译。作者们利用不同的目标蛋白定位,可以在同一个细胞内设计多个空间上的正交aaRS/tRNA配对,从而可以重复使用相同的终止密码子,在体内将不同的非经典氨基酸结合到不同的蛋白质中,有效地生成一个具有三个空间和功能上不同的翻译程序的细胞。
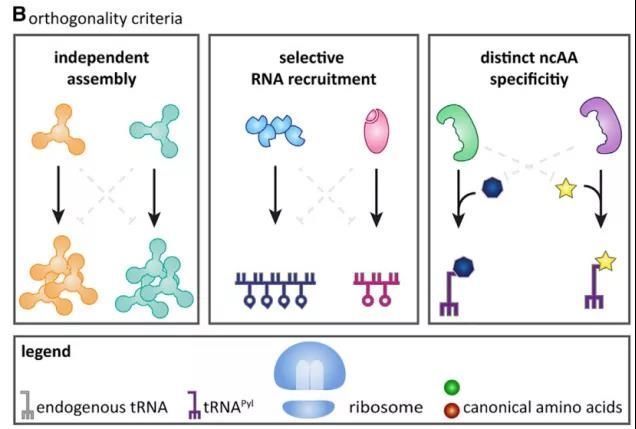
图2 多正交翻译系统需要满足多种标准
为了达到多正交翻译系统同时运作的目的,该系统需要至少满足三个重要标准:1)独立组装原则。即靶向细胞器的mRNA不能被宿主的标准翻译机制有效地翻译到细胞质中的其他地方;2)选择性RNA招募原则。每个正交细胞器必须募集特定的mRNA;3)非经典氨基酸特异性原则。不同的aaRS变体需要选择性地识别不同的非经典氨基酸(图2)。
作者们的设想是构建不同的正交细胞器,可以在不同细胞器由相分离介导形成薄膜状结构。因此,作者们将相分离结构域与不同的膜定位结构域结合,并将它们直接融合到PylRS或RNA结合蛋白上,从而可以将相分离凝聚体融合到不同的膜上,比如高尔基体、线粒体或者细胞质膜上(图2)。通过荧光标记流式细胞分选,作者们确认了该正交翻译细胞器中不同翻译过程的特异性,另外所有的正交翻译膜类似细胞器都与宿主在细胞质中的翻译不会产生交叉反应。另外,在ms2-MCP的系统基础上,作者们又引入了boxB-λN22可以同时进行双系统同时运作(图3)。
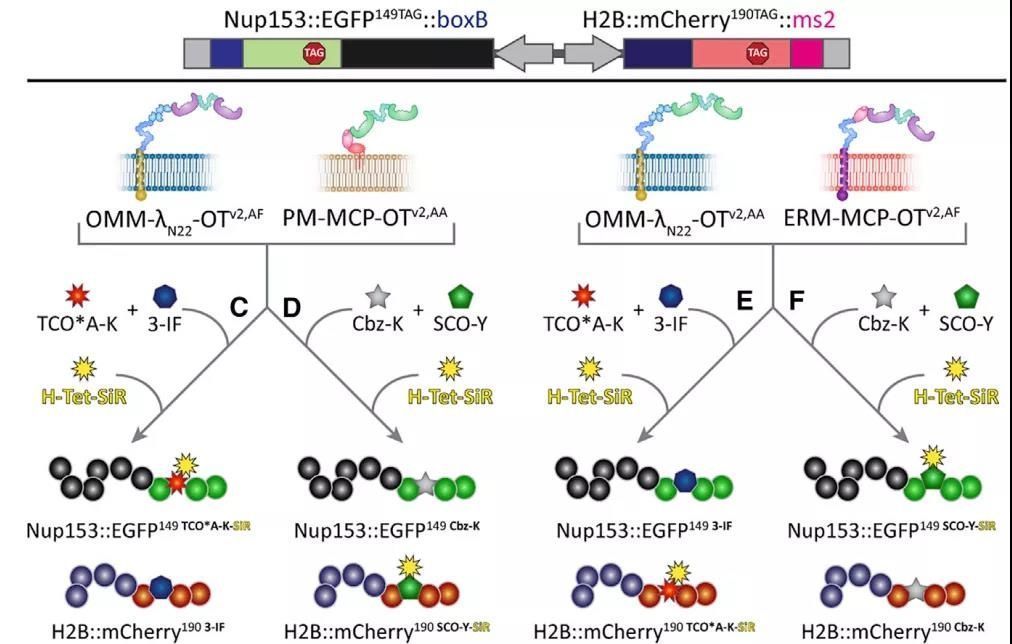
图3 以核孔蛋白Nup153与组蛋白H2B为例在不同正交系统的表达可以在细胞中进行特异性标记
文章来源:《生物技术》 网址: http://www.swjszz.cn/zonghexinwen/2022/0201/1153.html